Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
川越 総一郎*; 中川 洋; 久米田 博之*; 石森 浩一郎*; 齋尾 智英*
Journal of Biological Chemistry, 293(39), p.15095 - 15106, 2018/09
被引用回数:14 パーセンタイル:50.35(Biochemistry & Molecular Biology)分子シャペロンは、しばしば、クライアントタンパク質中のジスルフィド架橋およびシス形態のペプチジル-プロリル結合などの特定の構造要素の形成を補助することに特化した機能的モジュールを有する。ペプチジル-プロリルシス/トランスイソメラーゼ(PPIase)ドメイン(PPD)を有するリボソーム関連分子シャペロントリガーファクター(TF)は、ペプチジル-プロリル異性化によって制限される折りたたみプロセスにおいて非常に効率的な触媒として作用する。本論文では、TFがシス/トランス異性化プロセス中に折り畳まれていないクライアントタンパク質中のプロリン残基を認識する機構に関する成果を報告する。クライアントタンパク質と複合体を形成するTFの溶液構造は、TFが保存された疎水性領域を介して展開されていないクライアントタンパク質の疎水性領域に位置するプロリン-芳香族モチーフを認識することを示し、これはTFがペプチジル-プロリル結合の異性化を優先的に促進し、最終的にそのタンパク質のコアの中に折り畳まれる。分子動力学シミュレーションは、TFが転移状態でプロリン残基に先行するアミノ酸残基のカルボニル酸素との分子間水素結合を形成するためにI195の骨格アミド基と相互作用することを示した。これはおそらく転移状態を安定化し、したがって異性化を加速する。触媒中のこのような分子間水素結合形成の重要性は、活性アッセイおよびNMR緩和分析によってさらに裏付けられた。
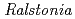 sp. A-471 reveals a unique arrangement of the catalytic residues for inverting chitin hydrolysis
sp. A-471 reveals a unique arrangement of the catalytic residues for inverting chitin hydrolysis有森 貴夫*; 川本 乃理子*; 新家 粧子*; 岡崎 伸生*; 中澤 昌美*; 宮武 和孝*; 深溝 慶*; 上田 光宏*; 玉田 太郎
Journal of Biological Chemistry, 288(26), p.18696 - 18706, 2013/07
被引用回数:30 パーセンタイル:64.37(Biochemistry & Molecular Biology)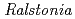 sp. A-471由来のキチナーゼC(Ra-ChiC)の活性ドメインはG型リゾチームと類似した配列を有し、他のキチナーゼとは異なりGHファミリー23に属する。しかしながら、NMRを用いた解析ではRa-ChiCはキチン二量体と相互作用する一方で、ペプチドグリカン断片とは相互作用しなかった。本論文では、Ra-ChiCの活性ドメイン(野生型, E141Q, E162Q変異体)及びキチンオリゴ糖複合体の結晶構造解析を報告する。Ra-ChiCは基質特異性をつかさどるトンネル構造を含む基質結合部位を有しており、そのトンネル上に位置するAsp226が塩基触媒として水分子を活性化する機構が構造情報に基づく変異体解析の結果から示唆された。構造的に高く保存された酸触媒として機能するGlu141とこのAsp226の相対配置は、他のGH23型酵素や反転型GH19キチナーゼとは異なっており、Ra-ChiCの特徴的な機能と関連していると考えられた。
sp. A-471由来のキチナーゼC(Ra-ChiC)の活性ドメインはG型リゾチームと類似した配列を有し、他のキチナーゼとは異なりGHファミリー23に属する。しかしながら、NMRを用いた解析ではRa-ChiCはキチン二量体と相互作用する一方で、ペプチドグリカン断片とは相互作用しなかった。本論文では、Ra-ChiCの活性ドメイン(野生型, E141Q, E162Q変異体)及びキチンオリゴ糖複合体の結晶構造解析を報告する。Ra-ChiCは基質特異性をつかさどるトンネル構造を含む基質結合部位を有しており、そのトンネル上に位置するAsp226が塩基触媒として水分子を活性化する機構が構造情報に基づく変異体解析の結果から示唆された。構造的に高く保存された酸触媒として機能するGlu141とこのAsp226の相対配置は、他のGH23型酵素や反転型GH19キチナーゼとは異なっており、Ra-ChiCの特徴的な機能と関連していると考えられた。
 -sheet-rich prion protein in scrapie-infected neuroblastoma cells with human IgG1 antibody specific for
-sheet-rich prion protein in scrapie-infected neuroblastoma cells with human IgG1 antibody specific for  -form prion protein
-form prion protein久保田 俊也*; 濱添 勇太*; 橋口 周平*; 石橋 大輔*; 赤坂 一之*; 西田 教行*; 片峰 茂*; 坂口 末廣*; 黒木 良太; 中島 敏博*; et al.
Journal of Biological Chemistry, 287(17), p.14023 - 14039, 2012/04
被引用回数:5 パーセンタイル:11.64(Biochemistry & Molecular Biology)遺伝子組み換え型の -sheet-rich recombinant full-length prion protein (
-sheet-rich recombinant full-length prion protein ( -form PrP)を準備し、この
-form PrP)を準備し、この -form PrPとヒト一本鎖抗体を提示したファージライブラリを用いて、
-form PrPとヒト一本鎖抗体を提示したファージライブラリを用いて、 -formではなく
-formではなく -form PrPに特異的なヒトIgG1抗体(PRB7 IgG)を確立した。プリオンに感染したScN2a細胞をPRB7 IgGと共培養させると、細胞質中でPRB7結合粒子が生成蓄積され、その結果、非常に大きなPRB7結合凝集体を生成するアポトーシスを起こした細胞となる。全長PrPのN末端のオクタリピート領域を認識するSAF32抗体は、共焦点顕微鏡法で決定されるようにこれらの細胞内の明瞭な粒子を染色した。PRB7 IgG又はSAF32の存在下で培養されたプリオン感染ScN2a細胞内でPK抵抗性PrPの蓄積を観察すると、SAF32によって強く阻害されたが、PRB7 IgGによっては全く阻害されなかった。このようにして、ScN2a細胞内の
-form PrPに特異的なヒトIgG1抗体(PRB7 IgG)を確立した。プリオンに感染したScN2a細胞をPRB7 IgGと共培養させると、細胞質中でPRB7結合粒子が生成蓄積され、その結果、非常に大きなPRB7結合凝集体を生成するアポトーシスを起こした細胞となる。全長PrPのN末端のオクタリピート領域を認識するSAF32抗体は、共焦点顕微鏡法で決定されるようにこれらの細胞内の明瞭な粒子を染色した。PRB7 IgG又はSAF32の存在下で培養されたプリオン感染ScN2a細胞内でPK抵抗性PrPの蓄積を観察すると、SAF32によって強く阻害されたが、PRB7 IgGによっては全く阻害されなかった。このようにして、ScN2a細胞内の -sheet-rich PrPの産生・蓄積の直接的証拠を新たに掴んだ。これらの結果は、(1)PRB7結合PrPが、
-sheet-rich PrPの産生・蓄積の直接的証拠を新たに掴んだ。これらの結果は、(1)PRB7結合PrPが、 -form PrP凝集体の蓄積に寄与していず、むしろ結果としてアポトーシス細胞死を引き起こす最終産物である、(2)PRB7が認識する
-form PrP凝集体の蓄積に寄与していず、むしろ結果としてアポトーシス細胞死を引き起こす最終産物である、(2)PRB7が認識する -formが欠乏したSAF32結合PrPは伝播性を伴ういわゆるPrP
-formが欠乏したSAF32結合PrPは伝播性を伴ういわゆるPrP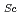 かもしれない、ということを示唆している。PRB7は、
かもしれない、ということを示唆している。PRB7は、 -form PrPに特異的な最初のヒト抗体であり、生化学的,病理学的なプリオンを特徴付けるための強力なツールになると考えられる。
-form PrPに特異的な最初のヒト抗体であり、生化学的,病理学的なプリオンを特徴付けるための強力なツールになると考えられる。
伊藤 栄近*; 鈴木 章一*; 金地 佐千子*; 白石 裕士*; 太田 昭一郎*; 有馬 和彦*; 田中 剛*; 玉田 太郎; 本庄 栄二郎*; Garcia, K. C.*; et al.
Journal of Biological Chemistry, 284(36), p.24289 - 24296, 2009/09
被引用回数:23 パーセンタイル:45.4(Biochemistry & Molecular Biology)IL-4とIL-13はともにIL-4受容体 鎖とIL-13受容体
鎖とIL-13受容体 -1鎖(IL-13R
-1鎖(IL-13R 1)を共通の受容体として結合する。しかしながら、これらリガンドタンパク質の受容体結合様式には違いがあり、この違いがリガンド特異的な機能の発現をつかさどっている。われわれはこれまでにIL-13R
1)を共通の受容体として結合する。しかしながら、これらリガンドタンパク質の受容体結合様式には違いがあり、この違いがリガンド特異的な機能の発現をつかさどっている。われわれはこれまでにIL-13R 1のIg様ドメイン(D1ドメイン)がIL-13結合に特異的かつ必要不可欠な領域であることを見いだした。しかしながら、受容体D1ドメイン中のどのアミノ酸がIL-13の特異的な結合に関与しているか、さらにはD1ドメインがIL-13とIL-4をどのように識別しているかはいまだ不明のままであった。これらの疑問を解決するために、本研究では、D1ドメインへの変異体解析を構造情報を利用することにより実施した。結晶構造中においてIL-13結合に関与しているC'ストランド中のLys76, Lys77, Ile78、及び結合部位に近接したTrp65, Ala79への変異導入はIL-13結合を顕著に低下させた。よって、これらのアミノ酸がIL-13結合部位を構成していることが明らかになった。また、他の
1のIg様ドメイン(D1ドメイン)がIL-13結合に特異的かつ必要不可欠な領域であることを見いだした。しかしながら、受容体D1ドメイン中のどのアミノ酸がIL-13の特異的な結合に関与しているか、さらにはD1ドメインがIL-13とIL-4をどのように識別しているかはいまだ不明のままであった。これらの疑問を解決するために、本研究では、D1ドメインへの変異体解析を構造情報を利用することにより実施した。結晶構造中においてIL-13結合に関与しているC'ストランド中のLys76, Lys77, Ile78、及び結合部位に近接したTrp65, Ala79への変異導入はIL-13結合を顕著に低下させた。よって、これらのアミノ酸がIL-13結合部位を構成していることが明らかになった。また、他の ストランド中のVal35, Leu38, Val42への変異導入もIL-13の結合低下をもたらした。これはこれらの変異導入がD1ドメインの構造安定性を低下させたことに起因すると推察された。さらに、上記の変異導入のいずれもIL-4結合には影響を及ぼさなかった。これらの結果から、Lys76, Lys77, Ile78から構成される疎水的な領域がIL-13特異的な認識部位として機能し、IL-4との識別を可能にしていると考えられた。
ストランド中のVal35, Leu38, Val42への変異導入もIL-13の結合低下をもたらした。これはこれらの変異導入がD1ドメインの構造安定性を低下させたことに起因すると推察された。さらに、上記の変異導入のいずれもIL-4結合には影響を及ぼさなかった。これらの結果から、Lys76, Lys77, Ile78から構成される疎水的な領域がIL-13特異的な認識部位として機能し、IL-4との識別を可能にしていると考えられた。